Kadang mencoba jujur itu membingungkan. . . ! Kepercayaan seseorang bisa dipertaruhkan dalam nilai kejujuran. Terlepas dari kebohongan yang telah dilakukan oleh seseorang, mulailah untuk mencoba jujur. Pilihannya hanya ada dua yaitu nyaman dan tidak nyaman, kenyamanan mungkin sulit tapi harus diperhatikan tingkatannya, kemudian ketidaknyamanan itu timbul dalam memori yang terdalam kita dimana ego kita berperan sebagai raja.
Kejujuran bisa menimbulkan kenyamanan dan ketidak nyamanan terhadap diri pribadi ataupun teman. Semuanya membuat bingung akan akibatnya, ketakutan dan rasa tidak enak akan menyelimuti setiap langkah kita untuk jujur. Cobalah mencari kenyamanan dalam kejujuran. Itu saja
Kamis, 30 Desember 2010
Selasa, 07 Desember 2010
Kata kerja operasional
Berikut ini adalah Kata kerja operasional
1. kognitif
a. Pengetahuan
- mendefinisikan
- memberi nama
- menyusun daftar
- mencocokkan
- menyebutkan
- membuat garis besar
- menyatakan kembali
- memilih
b. Pemahaman
- mengubah
- mempertahankan
- membedakan
-memperkirakan
- menjelaskan
- menyatakan secara luas
- menarik kesimpulan
- memberi contoh
- menulis dengan kata sendiri
- meramalkan
- menuliskan kembali
- mengelompokkan
c. Penerapan/aplikasi
- menghitung
- mendemonstrasikan
- menjumlahkan
- mengerjakan dengan teliti
- mengungkapkan
- mengubungkan
- menunjukkan
- menggunakan
d. Analisa
- mengurai
- membuat diagram
- memisahkan
- membedakan
- menggambarkan
- menyimpulkan
- merinci
e. Sintesa/pemaduan
- menggolongkan
- menggabungkan
- menghimpun
- menciptakan
- merencanakan
- menjelaskan
- membangkitkan
- mengorganisir
- merevisi
- menyimpulan
f. Evaluasi/penilaian
- menilai
- membandingkan
- mempertentangkan
- mengkritik
- membeda-bedakan
- mempertimbangkan
- kebenaran
- menyokong
2. Apektif/sikap
a. Penerimaan
- memilih
- membandingkan
- menanyakan
- menjawab
- menyatakan
- memberi
- menempatkan
- menjelaskan
- mengidentifikasi
- menggunakan
- mengemukakan
b. Penanggapan
- menyesuaikan
- membantu
- melaporkan
- mendiskusikan
- menyambut
- menawarkan
- mendatangi
- menampilkan
- melaksanakan
- menyumbangkan
- membawakan
- menyelesaikan
- menyatakan persetujuan
- mempraktikan
- menjawab
- menceritakan
- membentuk
- memenuhi
c. Penentuan sikap/penilaian
- mengikuti
- memilih
- menunjuk
- melaksanakan
- menyatakan pendapat
- mengambil prakarsa
- ikut serta
- menggabungkan diri
- mengundang
- mengusulkan
- membela
- menuntun
- membenarkan
- menolak
- mengajak
- melengkapi
- mempelajari
- membedakan
- mengerjakan
- membentuk
- mempertimbangkan
d. Pengorganisasian
- mengatur; mengintegrasikan
- melengkapi; merumuskan
- berpegang pada; menghubungkan
- mengaitkan; menyusun
- mengubah; menyempurnakan
- menyesuaikan; menyamakan
- membandingkan; mempertahankan
- memodifikasi; membela
- menyiapkan; menggeneralisasikan
- mengombinasikan; menggambarkan
- mengambil inisiatif
e. Pemeranan
- menunjukan
- mempraktekkan
- membuktikan
- bertindak
- menyatakan
- memperlihatkan
- melayani
- mengundurkan diri
- bertahan
- mempertimbangkan
- mempersoalkan
- memerankan
- menyelesaikan
- mendengarkan
- menggunakan
- mempengaruhi
- membedakan
3. Aspek Keterampilan
a. Persepsi (p1)
- memilih
- mengidentifikasi
- membedakan
- menyiapkan
- menyisihkan
- menunjukkan
- menghubungkan
- memisahkan
- menelusuri
- mendeskripsikan
- mengenal
- menentukan
b. Kesiapan (p2)
- menanggapi
- memulai
- mengawali beraksi
- mempersiapkan
- memprakarsai
- mempertunjukkan
- menilai
- memindahkan
- memeragakan
- bersedia melakukan
- melaksanakan
c. Respon (p3)
- mempraktikkan
-memainkan
- mengikuti
- mengerjakan
- membuat
- memperlihatkan
- memasang
- membongkar
- mengikat
- merakit
- membedah
- membetulkan
- membentuk
- mengukur
- menyetel
- mencampur
- membangun
- membetulkan
- membuka
- menutup
- membuat sketsa
d. Mekanisme (p4)
- mengoperasikan
- membangun
- melaksanakan
- mengerjakan
- membongkar
- menyusun
- menggunakan
- mengatur
- memainkan
- mendemonstrasikan
- menangani
- memasang
- memperbaiki
e, penyesuaian (p5)
- mengubah
- mengadaptasikan
- mengatur kembali
- membuat variasi
- menyesuaikan
- menyusun kembali
- memperbaiki
f. Kreativitas (p6)
- merancang
- menyusun
- menciptakan
- mendesain
- mengombinasikan
- mengatur
- merencanakan
- membangun
- mengubah
1. kognitif
a. Pengetahuan
- mendefinisikan
- memberi nama
- menyusun daftar
- mencocokkan
- menyebutkan
- membuat garis besar
- menyatakan kembali
- memilih
b. Pemahaman
- mengubah
- mempertahankan
- membedakan
-memperkirakan
- menjelaskan
- menyatakan secara luas
- menarik kesimpulan
- memberi contoh
- menulis dengan kata sendiri
- meramalkan
- menuliskan kembali
- mengelompokkan
c. Penerapan/aplikasi
- menghitung
- mendemonstrasikan
- menjumlahkan
- mengerjakan dengan teliti
- mengungkapkan
- mengubungkan
- menunjukkan
- menggunakan
d. Analisa
- mengurai
- membuat diagram
- memisahkan
- membedakan
- menggambarkan
- menyimpulkan
- merinci
e. Sintesa/pemaduan
- menggolongkan
- menggabungkan
- menghimpun
- menciptakan
- merencanakan
- menjelaskan
- membangkitkan
- mengorganisir
- merevisi
- menyimpulan
f. Evaluasi/penilaian
- menilai
- membandingkan
- mempertentangkan
- mengkritik
- membeda-bedakan
- mempertimbangkan
- kebenaran
- menyokong
2. Apektif/sikap
a. Penerimaan
- memilih
- membandingkan
- menanyakan
- menjawab
- menyatakan
- memberi
- menempatkan
- menjelaskan
- mengidentifikasi
- menggunakan
- mengemukakan
b. Penanggapan
- menyesuaikan
- membantu
- melaporkan
- mendiskusikan
- menyambut
- menawarkan
- mendatangi
- menampilkan
- melaksanakan
- menyumbangkan
- membawakan
- menyelesaikan
- menyatakan persetujuan
- mempraktikan
- menjawab
- menceritakan
- membentuk
- memenuhi
c. Penentuan sikap/penilaian
- mengikuti
- memilih
- menunjuk
- melaksanakan
- menyatakan pendapat
- mengambil prakarsa
- ikut serta
- menggabungkan diri
- mengundang
- mengusulkan
- membela
- menuntun
- membenarkan
- menolak
- mengajak
- melengkapi
- mempelajari
- membedakan
- mengerjakan
- membentuk
- mempertimbangkan
d. Pengorganisasian
- mengatur; mengintegrasikan
- melengkapi; merumuskan
- berpegang pada; menghubungkan
- mengaitkan; menyusun
- mengubah; menyempurnakan
- menyesuaikan; menyamakan
- membandingkan; mempertahankan
- memodifikasi; membela
- menyiapkan; menggeneralisasikan
- mengombinasikan; menggambarkan
- mengambil inisiatif
e. Pemeranan
- menunjukan
- mempraktekkan
- membuktikan
- bertindak
- menyatakan
- memperlihatkan
- melayani
- mengundurkan diri
- bertahan
- mempertimbangkan
- mempersoalkan
- memerankan
- menyelesaikan
- mendengarkan
- menggunakan
- mempengaruhi
- membedakan
3. Aspek Keterampilan
a. Persepsi (p1)
- memilih
- mengidentifikasi
- membedakan
- menyiapkan
- menyisihkan
- menunjukkan
- menghubungkan
- memisahkan
- menelusuri
- mendeskripsikan
- mengenal
- menentukan
b. Kesiapan (p2)
- menanggapi
- memulai
- mengawali beraksi
- mempersiapkan
- memprakarsai
- mempertunjukkan
- menilai
- memindahkan
- memeragakan
- bersedia melakukan
- melaksanakan
c. Respon (p3)
- mempraktikkan
-memainkan
- mengikuti
- mengerjakan
- membuat
- memperlihatkan
- memasang
- membongkar
- mengikat
- merakit
- membedah
- membetulkan
- membentuk
- mengukur
- menyetel
- mencampur
- membangun
- membetulkan
- membuka
- menutup
- membuat sketsa
d. Mekanisme (p4)
- mengoperasikan
- membangun
- melaksanakan
- mengerjakan
- membongkar
- menyusun
- menggunakan
- mengatur
- memainkan
- mendemonstrasikan
- menangani
- memasang
- memperbaiki
e, penyesuaian (p5)
- mengubah
- mengadaptasikan
- mengatur kembali
- membuat variasi
- menyesuaikan
- menyusun kembali
- memperbaiki
f. Kreativitas (p6)
- merancang
- menyusun
- menciptakan
- mendesain
- mengombinasikan
- mengatur
- merencanakan
- membangun
- mengubah
Ingatlah
Tak ada kata Semewah cinta, semegah asa, setajam mimpi dan seindah perasaan kecuali "hati". Karena hati lebih mewah, megah, tajam dan indah dari segalanya.…
Rabu, 01 Desember 2010
Kata-kata indah iwan fals untuk negara
Kata Kata Indah Iwan Falsmerupakan kata dan kalimat yang ada dalam lirik lagu yang dinyanyikan oleh iwan fals, selainkata bijak iwan fals,kata kata indah iwan falsini juga benar benar rangkaian kalimat yang penuh dan sarat dengan makna, coba saja simak dan resapi kalimat yang termaksud didalamnya.Berikut adalah sedikit yang sempat kami kumpulkan. Simak dan resapilah makna yang terkandung didalamnya. Semoga hari-hari kita menjadi lebih berguna.100 Kalimat Indah Dalam Lirik Lagu Iwan Fals dkk--------------------------------------------------------1.“Berhentilah jangan salah gunakan, kehebatan ilmu pengetahuan untuk menghancurkan”(Puing – album Sarjana Muda 1981)2.“Hei jangan ragu dan jangan malu, tunjukkan pada dunia bahwa sebenarnya kita mampu”.(Bangunlah Putra-Putri Pertiwi – album Sarjana Muda 1981)3."Cepatlah besar matahariku, menangis yang keras janganlah ragu, hantamlah sombongnya dunia buah hatiku, doa kami dinadimu”.(Galang Rambu Anarki – album Opini 1982)4.“Jalan masih teramat jauh, mustahil berlabuh bila dayung takterkayuh”.(Maaf Cintaku - album Sugali 1984)5.“Jangan kau paksakan untuk tetap terus berlari, bila luka di kaki belum terobati”.(Berkacalah Jakarta - album Sugali 1984)6.“Riak gelombang suatu rintangan, ingat itu pasti kan datang, karang tajam sepintas seram, usah gentar bersatu terjang”.(Cik - album Sore Tugu Pancoran 1985)7.“Aku tak sanggup berjanji, hanya mampu katakan aku cinta kau saat ini, entah esok hari, entah lusa nanti, entah”.(Entah - album Ethiopia 1986)8.“Mengapa bunga harus layu?, setelah kumbang dapatkan madu,mengapa kumbang harus ingkar?,setelah bunga tak lagi mekar”.(Bunga-Bunga Kumbang-Kumbang- album Ethiopia 1986)9.“Ternyata banyak hal yang takselesai hanya dengan amarah”.(Ya Ya Ya Oh Ya - album Aku Sayang Kamu 1986)10.“Dalam hari selalu ada kemungkinan, dalam hari pasti ada kesempatan”.(Selamat Tinggal Malam - album Aku Sayang Kamu 1986)--------------------------------------------------------11.“Kota adalah hutan belantara akal kuat dan berakar, menjurai didepan mata siap menjerat leherkita”.(Kota - album Aku Sayang Kamu 1986)12.“Jangan kita berpangku tangan, teruskan hasil perjuangan dengan jalan apa saja yang pasti kita temukan”.(Lancar - album Lancar 1987)13.“Jangan ragu jangan takut karang menghadang, bicaralah yang lantang jangan hanya diam”.(Surat Buat Wakil Rakyat - albumWakil Rakyat 1987)14.“Kau anak harapanku yang lahir di zaman gersang, segala sesuatu ada harga karena uang”.(Nak - album 1910 1988)15.“Sampai kapan mimpi mimpi itu kita beli?, sampai nanti sampai habis terjual harga diri”.(Mimpi Yang Terbeli - album 1910 1988)16.“Seperti udara kasih yang engkau berikan, tak mampu ku membalas, Ibu”.(Ibu - album 1910 1988)17.“Memang usia kita muda namun cinta soal hati, biar mereka bicara telinga kita terkunci”.(Buku Ini Aku Pinjam - album 19101988)18.“Dendam ada dimana mana di jantungku, di jantungmu, di jantung hari-hari”.(Ada Lagi Yang Mati - album 19101988)19.“Hangatkan tubuh di cerah pagi pada matahari, keringkan hati yang penuh tangis walau hanya sesaat”.(Perempuan Malam - album Mata Dewa 1989)20.“Kucoba berkaca pada jejak yang ada, ternyata aku sudah tertinggal, bahkan jauh tertinggal”.(Nona - album Mata Dewa 1989)--------------------------------------------------------21.“Oh ya! ya nasib, nasibmu jelasbukan nasibku, oh ya! ya takdir, takdirmu jelas bukan takdirku”.(Oh Ya! - album Swami 1989)22.“Wahai kawan hei kawan, bangunlah dari tidurmu, masih ada waktu untuk kita berbuat, luka di bumi ini milik bersama, buanglah mimpi-mimpi”.(Eseks eseks udug udug (Nyanyian Ujung Gang) - album Swami 1989)23.“Api revolusi, haruskah padam digantikan figur yang tak pasti?”.(Condet - album Swami 1989)24.“Kalau cinta sudah di buang, jangan harap keadilan akan datang”.(Bongkar - album Swami 1989)25.“Kesedihan hanya tontonan, bagi mereka yang diperkuda jabatan”.(Bongkar - album Swami 1989)26.“Orang tua pandanglah kami sebagai manusia, kami bertanya tolong kau jawab dengan cinta”.(Bongkar - album Swami 1989)27.“Satu luka perasaan, maki pujidan hinaan, tidak merubah sang jagoan menjadi makhluk picisan”.(Rajawali - album Kantata Takwa 1990)28.“Kesadaran adalah matahari, kesabaran adalah bumi, keberanian menjadi cakrawala, dan perjuangan adalah pelaksanaan kata kata”.(Paman Doblang - album Kantata Takwa 1990)29.“Mereka yang pernah kalah, belum tentu menyerah”.(Orang-Orang Kalah - album Kantata Takwa 1990)30.“Aku rasa hidup tanpa jiwa, orang yang miskin ataupun kaya sama ganasnya terhadap harta”.(Nocturno - album Kantata Takwa 1990)--------------------------------------------------------31.“Orang orang harus dibangunkan, kenyataan harus dikabarkan, aku bernyanyi menjadi saksi”.(Kesaksian - album Kantata Takwa 1990)32.“Ingatlah Allah yang menciptakan, Allah tempatku berpegang dan bertawakal, Allah maha tinggi dan maha esa, Allah maha lembut”.(Kantata Takwa - album KantataTakwa 1990)33.“Kebimbangan lahirkan gelisah,jiwa gelisah bagai halilintar”.(Gelisah - album Kantata Takwa 1990)34.“Bagaimanapun aku harus kembali, walau berat aku rasa kau mengerti”.(Air Mata - album Kantata Takwa1990)35.“Alam semesta menerima perlakuan sia sia, diracun jalan napasnya diperkosa kesuburannya”.(Untuk Bram - album Cikal 1991)36.“Duhai langit, duhai bumi, duhaialam raya, kuserahkan ragaku padamu, duhai ada, duhai tiada, duhai cinta, ku percaya”.(Pulang Kerja - album Cikal 1991)37.“Dimana kehidupan disitulah jawaban”.(Alam Malam - album Cikal 1991)38.“Ada dan tak ada nyatanya ada”.(Ada - album Cikal 1991)39.“Aku sering ditikam cinta, pernah dilemparkan badai, tapi aku tetap berdiri”.(Nyanyian Jiwa - album Swami Il 1991)40.“Aku mau jujur jujur saja, bicara apa adanya, aku tak mau mengingkari hati nurani”.(Hio - album Swami Il 1991)--------------------------------------------------------41.“Bibirku bergerak tetap nyanyikan cinta walau aku tahu tak terdengar, jariku menari tetap tak akan berhenti sampai wajah tak murung lagi”.(Di Mata Air Tidak Ada Air Mata -album Belum Ada Judul 1992)42.“Mengapa besar selalu menang?, bebas berbuat sewenang wenang, mengapa kecilselalu tersingkir?, harus mengalah dan menyingkir”.(Besar Dan Kecil - album Belum Ada Judul 1992)43.“Angin pagi dan nyanyian sekelompok anak muda mengusik ingatanku, aku ingat mimpiku, aku ingat harapan yang semakin hari semakin panjang tak berujung”.(Aku Disini - album Belum Ada Judul 1992)44.“Jalani hidup, tenang tenang tenanglah seperti karang”.(Lagu Satu - album Hijau 1992)45.“Sebentar lagi kita akan menjual air mata kita sendiri, karena air mata kita adalah air kehidupan”.(Lagu Dua - album Hijau 1992)46.“Kita harus mulai bekerja, persoalan begitu menantang, satu niat satulah darah kita, kamu adalah kamu aku adalah aku”.(Lagu Tiga - album Hijau 1992)47.“Kenapa kebenaran tak lagi dicari?, sudah tak pentingkah bagi manusia?”(Lagu Empat- album Hijau 1992)48.“Kenapa banyak orang ingin menang?, apakah itu hasil akhir kehidupan?”.(Lagu Empat- album Hijau 1992)49.“Anjingku menggonggong protes pada situasi, hatiku melolong protes pada kamu”.(Lagu Lima - album Hijau 1992)50.“Biar keadilan sulit terpenuhi, biar kedamaian sulit terpenuhi, kami berdiri menjaga dirimu”.(Karena Kau Bunda Kami - album Dalbo 1993)--------------------------------------------------------51.“Apa jadinya jika mulut dilarang bicara?, apa jadinya jika mata dilarang melihat?, apa jadinya jika telinga dilarang mendengar?, jadilah robot tanpa nyawa yang hanya mengabdi pada perintah”.(Hura Hura Huru Hara - album Dalbo 1993)52.“Tertawa itu sehat, menipu itujahat”.(Hua Ha Ha - album Dalbo 1993)53.“Nyanyian duka nyanyian suka, tarian duka tarian suka, apakah ada bedanya?”(Terminal – single 1994)54.“Waktu terus bergulir, kita akan pergi dan ditinggal pergi”.(Satu Satu – album Orang Gila 1994)55.“Pelan-pelan sayang kalau mulai bosan, jangan marah-marahnanti cepat mati, santai sajalah”.(Menunggu Ditimbang Malah Muntah – album Orang Gila 1994)56.“Mau insaf susah, desa sudah menjadi kota”.(Menunggu Ditimbang Malah Muntah – album Orang Gila 1994)57.“Pertemuan dan perpisahan, dimana awal akhirnya?, dimana bedanya?”.(Doa Dalam Sunyi – album Orang Gila 1994)58.“Jika kata tak lagi bermakna, lebih baik diam saja”.(Awang Awang – album Orang Gila1994)59.“Bagaimana bisa mengerti?, sedang kita belum berpikir, bagaimana bisa dianggap diam?, sedang kita belum bicara”.(Awang Awang – album Orang Gila1994)60.“Aku bukan seperti nyamuk yang menghisap darahmu, aku manusia yang berbuat sesuai aturan dan keinginan”.(Nasib Nyamuk – album Anak Wayang 1994)--------------------------------------------------------61.“Oh susahnya hidup, urusan hati belum selesai, rumah tetangga digusur raksasa, pengusaha zaman merdeka”.(Oh – single 1995)62.“Aku disampingmu begitu pasti,yang tak kumengerti masih saja terasa sepi”.(Mata Hati – album Mata Hati 1995)63.“Sang jari menari jangan berhenti, kupasrahkan diriku digenggaman-Mu”.(Lagu Pemanjat – album Lagu Pemanjat 1996)64.“Lepaslah belenggu ragu yang membelit hati, melangkah denganpasti menuju gerbang baru”.(Songsonglah – album Kantata Samsara 1998)65.“Berani konsekuen pertanda jantan”.(Nyanyian Preman – album Kantata Samsara 1998)66.“Dengarlah suara bening dalamhatimu, biarlah nuranimu berbicara”.(Langgam Lawu – album Kantata Samsara 1998)67.“Matinya seorang penyaksi bukan matinya kesaksian”.(Lagu Buat Penyaksi – album Kantata Samsara 1998)68.“Bertahan hidup harus bisa bersikap lembut, walau hati panas bahkan terbakar sekalipun”.(Di Ujung Abad - album Suara Hati2002)69.“Jangan goyah percayalah teman perang itu melawan diri sendiri, selamat datang kemerdekaan kalau kita mampu menahan diri”.(Dendam Damai - album Suara Hati 2002)70.“Berdoalah sambil berusaha, agar hidup jadi tak sia-sia”.(Doa - album Suara Hati 2002)--------------------------------------------------------71.“Harta dunia jadi penggoda, membuat miskin jiwa kita”.(Seperti Matahari - album Suara Hati 2002)72.“Memberi itu terangkan hati, seperti matahari yang menyinari bumi”.(Seperti Matahari - album Suara Hati 2002)73.“Jangan heran korupsi menjadijadi, habis itulah yang diajarkan”.(Politik Uang – album Manusia Setengah Dewa 2004)74.“Gelombang cinta gelombang kesadaran merobek langit yang mendung, menyongsong hari esokyang lebih baik”.(Para Tentara – album Manusia Setengah Dewa 2004)75.“Terhadap yang benar saja sewenang wenang, apalagi yang salah”.(Mungkin – album Manusia Setengah Dewa 2004)76.“Begitu mudahnya nyawa melayang, padahal tanpa diundang pun kematian pasti datang”.(Matahari Bulan Dan Bintang – album Manusia Setengah Dewa 2004)77.“Dunia kita satu, kenapa kita tidak bersatu?”.(Matahari Bulan Dan Bintang – album Manusia Setengah Dewa 2004)78.“Urus saja moralmu urus saja akhlakmu, peraturan yang sehat yang kami mau”.(Manusia Setengah Dewa – albumManusia Setengah Dewa 2004)79.“Di lumbung kita menabung, datang paceklik kita tak bingung”.(Desa – album Manusia Setengah Dewa 2004)80.“Tutup lubang gali lubang falsafah hidup jaman sekarang”.(Dan Orde Paling Baru – album Manusia Setengah Dewa 2004)--------------------------------------------------------81.“Buktikan buktikan!, kalau hanya omong burung beo pun bisa”.(Buktikan – album Manusia Setengah Dewa 2004)82.“Dunia politik dunia bintang, dunia hura hura para binatang”.(Asik Nggak Asik – album ManusiaSetengah Dewa 2004)83.“Dewa-dewa kerjanya berpesta, sambil nyogok bangsa manusia”.(17 Juli 1996 – album Manusia Setengah Dewa 2004)84.“Tanam-tanam pohon kehidupan, siram siram sirami dengan sayang, tanam tanam tanam masa depan, benalu-benalu kita bersihkan”.(Tanam-Tanam Siram-Siram – single 2006)85.“Ada apa gerangan mengapa mesti tergesa gesa, tak bisakah tenang menikmati bulan penuh dan bintang”.(Haruskah Pergi – 2006)86.“Persoalan hidup kalau diikuti tak ada habisnya, soal lama pergisoal baru datang”.(Selancar – 2006)87.“Jaman berubah perilaku tak berubah, orang berubah tingkah laku tak berubah”.(Rubah – album 50:50 2007)88.“Satu hilang seribu terbilang, patah tumbuh hilang berganti”.(Pulanglah – album 50:50 2007)89.“Hidup ini indah berdua semua mudah, yakinlah melangkah jangan lagi gelisah”.(KaSaCiMa – album 50:50 2007)90.“Tak ada yang lepas dari kematian, tak ada yang bisa sembunyi dari kematian, pasti”.(Ikan-Ikan – album 50:50 2007)--------------------------------------------------------91.“Ada kamu yang mengatur ini semua tapi rasanya percuma, ada juga yang janjikan indahnya surga tapi neraka terasa”.(Cemburu – album 50:50 2007)92.“Hukum alam berjalan menggilas ludah, hukum Tuhan katakan “Sabar!”.(Kemarau – uncassette)93.“Yang pasti hidup ini keras, tabahlah terimalah”.(Joned – uncassette)94.“Oh negeriku sayang bangkit kembali, jangan berkecil hati bangkit kembali”.(Harapan Tak Boleh Mati – uncassette)95.“Oh yang ditinggalkan tabahlah sayang, ini rahmat dari Tuhan kita juga pasti pulang”.(Harapan Tak Boleh Mati – uncassette)96.“Tuhan ampunilah kami, ampunidosa-dosa kami, ampuni kesombongan kami, ampuni bangsa kami, terimalah disisi-Mu korban bencana ini”.(Saat Minggu Masih Pagi – uncassette)97.“Nyatakan saja apa yang terasa walau pahit biasanya, jangan disimpan jangan dipendam,merdekakan jiwa”.(Nyatakan Saja – uncassette)98.“Usiamu tak lagi muda untuk terus terusan terjajah, jangan lagi membungkuk bungkuk agar dunia mengakuimu”.(Merdeka – uncassette)99.“Kau paksa kami untuk menahan luka ini, sedangkan kau sendiri telah lupa”.(Luka Lama – uncassette)100. “Oh Tuhan tolonglah, lindungikami dari kekhilafan, oh ya Tuhantolonglah, Ramadhan mengetuk hati orang orang yang gila perang”.
Sabtu, 20 November 2010
Antara pendidikan dan kenyataan
Kita sadari betul, pendidikan dan kenyataan itu berhubungan. Keterkaitan keduanya dapat disimpulkan dalam hal:
1. Tingkah laku
2. Kebiasaan
3. Nilai
4. Kesejahteraan
hal yang memungkinkan perubahan tingkah laku belum tentu dapat sinkron antara pendidikan dan kenyataan. Tingkah laku ditandai dengan adanya pola yang teratur dan berkesinambungan dalam memahami diri sendiri dengan lingkungan baik secara intrapersonal maupun interpersonal yang ditunjukan dalam tindakan sosial. Pendidikan berfungsi mengatur tingkah laku individu tersebut agar tetap berada pada arah dan jalur yang baik. Kenyataan sendiri memerlukan hal yang sama dengan pendidikan yang berarti pendidikan itu merupakan konsep dari kenyataan. Ide-ide muncul dari pendidikan yang diaplikasikan dalam kenyataan.
1. Tingkah laku
2. Kebiasaan
3. Nilai
4. Kesejahteraan
hal yang memungkinkan perubahan tingkah laku belum tentu dapat sinkron antara pendidikan dan kenyataan. Tingkah laku ditandai dengan adanya pola yang teratur dan berkesinambungan dalam memahami diri sendiri dengan lingkungan baik secara intrapersonal maupun interpersonal yang ditunjukan dalam tindakan sosial. Pendidikan berfungsi mengatur tingkah laku individu tersebut agar tetap berada pada arah dan jalur yang baik. Kenyataan sendiri memerlukan hal yang sama dengan pendidikan yang berarti pendidikan itu merupakan konsep dari kenyataan. Ide-ide muncul dari pendidikan yang diaplikasikan dalam kenyataan.
Rabu, 03 November 2010
Daftar referensi model pembelajaran
1. Model pembelajaran terpadu
2. Model belajar kontruktivis
3. Model pembelajaran interaktif
4. Model pembelajaran kooperatif learning
5. Model pembelajaran picture and picture
6. Model siklus belajar (learning cycle)
7. Model tematik
8. Model inquiry
9. Model contextual teaching and learning
10. Model pembelajaran STM
11. Model pembelajaran lingkungan
12. Model pembelajaran kooperatif type NHT
13. Model pembelajaran kooperatif type STAD
14. Model pembelajaran kooperatif type TGT
15. Model pembelajaran kooperatif type Jigsaw
16. Model pembelajaran CLIS
17. Model pembelajaran SETS
18. Model pembelajaran PAKEM
19. Model pembelajaran media IT
20. Model pembelajaran media kebun binatang
21. Model pembelajaran karya wisata
22. Model pembelajaran eksperimen
23. Model pembelajaran aktif learning
24. Model pembelajaran role playing
25. Model pembelajaran Sains berbasis proyek
26. Model pembelajaran hands on aktivity
27. Model pembelajaran Quantum learning
28. Model pembelajaran problem solving
29. Model pembelajaran partisipatif
30. Model pembelajaran belajar tuntas
31. Model pembelajaran dengan modul
32. Model pembelajaran menggunakan media Komik
33. Model pembelajaran cooperative script
34. Model pembelajaran teknik probing prompting
35. Model pembelajaran TAI (Team Assisted individually)
36. Model pembelajaran memorisasi
37. Model pembelajaran heuristik
38. Model pembelajaran multiple inteligen
39. Model pembelajaran alam sekitar
40. Model pembelajaran based learning
41. Model pembelajaran individual dan klasikal
42. Model pembelajaran induktif deduktif
43. Model pembelajaran interaksi sosial
2. Model belajar kontruktivis
3. Model pembelajaran interaktif
4. Model pembelajaran kooperatif learning
5. Model pembelajaran picture and picture
6. Model siklus belajar (learning cycle)
7. Model tematik
8. Model inquiry
9. Model contextual teaching and learning
10. Model pembelajaran STM
11. Model pembelajaran lingkungan
12. Model pembelajaran kooperatif type NHT
13. Model pembelajaran kooperatif type STAD
14. Model pembelajaran kooperatif type TGT
15. Model pembelajaran kooperatif type Jigsaw
16. Model pembelajaran CLIS
17. Model pembelajaran SETS
18. Model pembelajaran PAKEM
19. Model pembelajaran media IT
20. Model pembelajaran media kebun binatang
21. Model pembelajaran karya wisata
22. Model pembelajaran eksperimen
23. Model pembelajaran aktif learning
24. Model pembelajaran role playing
25. Model pembelajaran Sains berbasis proyek
26. Model pembelajaran hands on aktivity
27. Model pembelajaran Quantum learning
28. Model pembelajaran problem solving
29. Model pembelajaran partisipatif
30. Model pembelajaran belajar tuntas
31. Model pembelajaran dengan modul
32. Model pembelajaran menggunakan media Komik
33. Model pembelajaran cooperative script
34. Model pembelajaran teknik probing prompting
35. Model pembelajaran TAI (Team Assisted individually)
36. Model pembelajaran memorisasi
37. Model pembelajaran heuristik
38. Model pembelajaran multiple inteligen
39. Model pembelajaran alam sekitar
40. Model pembelajaran based learning
41. Model pembelajaran individual dan klasikal
42. Model pembelajaran induktif deduktif
43. Model pembelajaran interaksi sosial
Senin, 25 Oktober 2010
Kata-kata bijak
Ini adalah kumpulan kata-kata bijak buatan sendiri di ambil dari pengalaman atau ucapan yang di dengar atau yang di ucapkan serta yang dirasakan sendiri.
- sungguh baik menjadi orang penting tapi jauh lebih penting menjadi orang baik
- kita tidak perlu harus tahu semuanya, tapi kita hanya perlu percaya
- hidup itu indah bila kita mensyukurinya
- teknologi ada karna imajinasi, imajinasi adalah awal dari kehidupan
- tidak semua orang bisa menjadi terkenal tapi semua orang bisa menjadi hebat
- rumput tetangga selalu lebih hijau daripada rumput sendiri
- uang akan membuat kita berubah dan karenanya lah kita akan melanggar aturan
- tanam kebaikan itu seperti menanam pohon, kita tak tahu seberapa banyak buah dari pohon tersebut. . Untuk itu tanamlah kebaikan sebanyak mungkin
- aku tak mau melepas bahagiaku karena uang, aku juga tak mau melepas sengsaraku karena uang, karena suatu saat uang itu akan melepaskan diriku yang sesungguhnya.
- sungguh baik menjadi orang penting tapi jauh lebih penting menjadi orang baik
- kita tidak perlu harus tahu semuanya, tapi kita hanya perlu percaya
- hidup itu indah bila kita mensyukurinya
- teknologi ada karna imajinasi, imajinasi adalah awal dari kehidupan
- tidak semua orang bisa menjadi terkenal tapi semua orang bisa menjadi hebat
- rumput tetangga selalu lebih hijau daripada rumput sendiri
- uang akan membuat kita berubah dan karenanya lah kita akan melanggar aturan
- tanam kebaikan itu seperti menanam pohon, kita tak tahu seberapa banyak buah dari pohon tersebut. . Untuk itu tanamlah kebaikan sebanyak mungkin
- aku tak mau melepas bahagiaku karena uang, aku juga tak mau melepas sengsaraku karena uang, karena suatu saat uang itu akan melepaskan diriku yang sesungguhnya.
Minggu, 24 Oktober 2010
Fungsi vitamin pada tubuh manusia
Fungsi Vitamin pada Tubuh Manusia
1. Vitamin C
Vitamin C dikenal sebagai asam askorbik, merupakan faktor utama yang mengontrol dan membangkitkan beberapa aspek pertahanan serta ketahanan tubuh terhadap serangan penyakit, termasuk kanker, infeksi gusi, varikosa (penonjolan pembuluh darah pada betis dan paha), dll.
2. Vitamin E
Vitamin E sebagai antioksidan (kerusakan berbagai sel dan jaringan tubuh), membantu mata tetap awet, sebagai anti polusi (penyakit yang diakibatkan oleh polusi udara), meningkatkan HDL, dll.
3. Vitamin A
Vitamin A adalah sejenis vitamin yang larut dalam lemak. Vitamin ini menjaga integritas kulit dan dinding pelapis saluran pernafasan serta saluran pencernaan, yang merupakan benteng utama terhadap serangan bakteri dan mikro-organisme lain.Vitamin A juga berfungsi menurunkan insiden kanker.
4. Vitamin B 12
Pada usila sering dijumpai kekurangan vitamin B12. Hal tersebut dapat menyebabkan kekurangan darah (anemia), gangguan saraf tepi, dan sebagainya.
Beberapa Resep dengan Buah dan Sayuran
1. Alpukat ( Persea americana MIII)
Khasiat buah alpukat antara lain menurunkan kolesterol, membantu regenerasi darah merah dan mencegah anemia, melembabkan kulit, serta mencegah sembelit.
Kandungan gizi:
*.Energi 93.00Kal
*.Fosfor 24.00mg
*.Protein 0,90g
*.Serat 1,40g
*.Lemak 6,20g
*.Besi 0.80mg
*.Karbohidrat 10,50g
*.Vit A 70.00RE
*.Kalsium 6,00mg
*.Vit B10,05mg
*.Vit B 20,06mg
*.Vit C13,00mg
2. Jeruk bali (Citrus maxima)
Khasiat jeruk bali antara lain menurunkan kolesterol, anti kanker, menurunkan risiko penyakit jantung, menormalkan tingkat hematokrit, dan membersihkan sel darah merah.
Kandungan gizi:
*.Energi 46,00kal
*.Protein 0.80g
*.Lemak 0,80g
*.Karbohidrat 10,10g
*.Kalsium 26,00mg
*.Fosfor 16,00mg
*.Serat 0,40g
*.Besi 0,70mg
*.Vit A 30.00 RE
*.Vit B 10,05mg
*.Vit B 20,02mg
*.Vit C 40,00mg
*.Niacin 0,20g
3. Melon (Cucumis melo cantalupensis)
Khasiat melon antara lain membantu sistem pembuangan, anti kanker, menurunkan risiko penyakit jantung dan stroke, serta mencegahpenggumpalan darah.
Kandungan gizi:
*.Energi 21 kal
*.Protein 0,60g
*.Lemak 0,10g
*.Karbohidrat 5,10g
*.Kalsium 15,00mg
*.Fosfor 25,00mg
*.Serat 0,30g
*.Besi 0,50mg
*.Vit A 640,00 SI
*.Vit B1 0.03mg
*.Vit B2 0,02mg
*.Vit C 34,00mg
*.Niacin 0,80mg
4. Asparagus (Asparagus officinalis)
Khasiat asparagus antara lain mengobati gangguan ginjal, mengobati hipertensi, mencegah anemia, dan mencegah konstipasi.
Kandungan gizi:
*.Energi 14kal
*.Protein1,60g
*.Lemak 0,20g
*.Karbohidrat 2,40g
*.Kalsium 10,00mg
*.Fosfor 39,00mg
*.Vit A 125,00 RE
*.Vit B1 0.10mg
*.Vit B2 0102mg
*.Vit C 12,00mg
*.Niacin 1,20mg
5. Bawang putih (Allium sativum)
Khasiat bawang putih antara lain sebagai obat sakit gigi, sakit telinga, diare, disentri, vaginitas, diptheri, menurunkan darah tinggi, menurunkan kolesterol, menurunkan gula darah pada penderita diabetes, membantu menghilangkan logam berat, menambah kekebalan, melindungi serangan kanker, pengobatan asma dan gangguan pernafasan, serta pengobatan gangguan pencernaan.
Kandungan gizi bawang putih :
*.Energi 116,00kal
*.Protein7,00g
*.Lemak 0,30g
*.Karbohidrat 24,60g
*.Kalsium 28,00mg
*.Fosfor 121,00mg
*.Serat 1,10g
*.Besi 0,20m,g
*.Vit A -
*.Vit B1 0.23mg
*.Vit B2 0,08mg
*.Vit C7,00mg
*.Niacin 0,40mg
6. Bit (Beta vulgaris)
Khasiat bit antara lain pengobatan hati dan kantung empedu, penghancur sel tumor atau kanker, mencegah anemia, dan menurunkan kolesterol.
Kandungan gizi bit antara lain:
*.Energi 147,00kal
*.Protein5,40g
*.Lemak 0,30g
*.Karbohidrat 32,60g
*.Kalsium 51,00mg
*.Fosfor 928,00mg
*.Serat 0,80g
*.Besi 3,40m,g
*.Vit A 22700,00 UI
*.Vit B1 0.07mg
*.Vit B2 0,16mg
*.Vit C 80,00mg
*.Niacin 1,50mg
7. Cabai (Capsicum annuum)
Khasiat cabai antara lain pembersih paru, pengobatan bronchitis, pengobatan masuk angin, pengobatan sinusitis, dan asma.
Kandungan gizi cabai antara lain:
*.Energi 31,00kal
*.Protein 7100g
*.Lemak0,30g
*.Karbohidrat 7,30g
*.Kalsium 29,00mg
*.Fosfor 24,00mg
*.Serat 0,30g
*.Besi 0,50m,g
*.Vit A 71,00RE
*.Vit B10.05mg
*.Vit B2 0,03mg
*.Vit C18,00mg
*.Niacin 0,20mg
8. Jagung ( Zen mays lina)
Khasiat jagung antara lain pembangun otot dan tulang, baik untuk otak dan sistem syaraf, mencegah konstipasi, menurunkan risiko kanker dan jantung, mencegah gigi berlubang, serta minyaknya dapat menurunkan kolesterol darah.
Kandungan gizi jagung:
*.Energi 150,00kal
*.Protein 1,600g
*.Lemak 0,60g
*.Karbohidrat 11,40g
*.Kalsium 2,00mg
*.Fosfor 47,00mg
*.Serat 0,40g
*.Besi 0,30m,g
*.Vit A 30,00 RE
*.Vit B1 0.07mg
*.Vit B2 0,04mg
*.Vit C 3,00mg
*.Niacin0,60mg
9. Kecambah (Bean sprouts)
Khasiat kecambah antara lain memperlambat proses penuaan, anti kanker, menambah kesuburan, dan memperlancar pencernaan.
Kandungan gizi pada kecambah antara lain :
*.Energi 50,00kal
*.Protein 5,70g
*.Lemak 0,10g
*.Karbohidrat 10,00g
*.Kalsium 32,00mg
*.Fosfor 96,00mg
*.Serat 0,70g
*.Besi 1,10m,g
*.Vit A1 3.00RE
*.Vit B10.13mg
*.Vit B2 0,15mg
*.Vit C41,00mg
*.Niacin 1,00mg
1. Vitamin C
Vitamin C dikenal sebagai asam askorbik, merupakan faktor utama yang mengontrol dan membangkitkan beberapa aspek pertahanan serta ketahanan tubuh terhadap serangan penyakit, termasuk kanker, infeksi gusi, varikosa (penonjolan pembuluh darah pada betis dan paha), dll.
2. Vitamin E
Vitamin E sebagai antioksidan (kerusakan berbagai sel dan jaringan tubuh), membantu mata tetap awet, sebagai anti polusi (penyakit yang diakibatkan oleh polusi udara), meningkatkan HDL, dll.
3. Vitamin A
Vitamin A adalah sejenis vitamin yang larut dalam lemak. Vitamin ini menjaga integritas kulit dan dinding pelapis saluran pernafasan serta saluran pencernaan, yang merupakan benteng utama terhadap serangan bakteri dan mikro-organisme lain.Vitamin A juga berfungsi menurunkan insiden kanker.
4. Vitamin B 12
Pada usila sering dijumpai kekurangan vitamin B12. Hal tersebut dapat menyebabkan kekurangan darah (anemia), gangguan saraf tepi, dan sebagainya.
Beberapa Resep dengan Buah dan Sayuran
1. Alpukat ( Persea americana MIII)
Khasiat buah alpukat antara lain menurunkan kolesterol, membantu regenerasi darah merah dan mencegah anemia, melembabkan kulit, serta mencegah sembelit.
Kandungan gizi:
*.Energi 93.00Kal
*.Fosfor 24.00mg
*.Protein 0,90g
*.Serat 1,40g
*.Lemak 6,20g
*.Besi 0.80mg
*.Karbohidrat 10,50g
*.Vit A 70.00RE
*.Kalsium 6,00mg
*.Vit B10,05mg
*.Vit B 20,06mg
*.Vit C13,00mg
2. Jeruk bali (Citrus maxima)
Khasiat jeruk bali antara lain menurunkan kolesterol, anti kanker, menurunkan risiko penyakit jantung, menormalkan tingkat hematokrit, dan membersihkan sel darah merah.
Kandungan gizi:
*.Energi 46,00kal
*.Protein 0.80g
*.Lemak 0,80g
*.Karbohidrat 10,10g
*.Kalsium 26,00mg
*.Fosfor 16,00mg
*.Serat 0,40g
*.Besi 0,70mg
*.Vit A 30.00 RE
*.Vit B 10,05mg
*.Vit B 20,02mg
*.Vit C 40,00mg
*.Niacin 0,20g
3. Melon (Cucumis melo cantalupensis)
Khasiat melon antara lain membantu sistem pembuangan, anti kanker, menurunkan risiko penyakit jantung dan stroke, serta mencegahpenggumpalan darah.
Kandungan gizi:
*.Energi 21 kal
*.Protein 0,60g
*.Lemak 0,10g
*.Karbohidrat 5,10g
*.Kalsium 15,00mg
*.Fosfor 25,00mg
*.Serat 0,30g
*.Besi 0,50mg
*.Vit A 640,00 SI
*.Vit B1 0.03mg
*.Vit B2 0,02mg
*.Vit C 34,00mg
*.Niacin 0,80mg
4. Asparagus (Asparagus officinalis)
Khasiat asparagus antara lain mengobati gangguan ginjal, mengobati hipertensi, mencegah anemia, dan mencegah konstipasi.
Kandungan gizi:
*.Energi 14kal
*.Protein1,60g
*.Lemak 0,20g
*.Karbohidrat 2,40g
*.Kalsium 10,00mg
*.Fosfor 39,00mg
*.Vit A 125,00 RE
*.Vit B1 0.10mg
*.Vit B2 0102mg
*.Vit C 12,00mg
*.Niacin 1,20mg
5. Bawang putih (Allium sativum)
Khasiat bawang putih antara lain sebagai obat sakit gigi, sakit telinga, diare, disentri, vaginitas, diptheri, menurunkan darah tinggi, menurunkan kolesterol, menurunkan gula darah pada penderita diabetes, membantu menghilangkan logam berat, menambah kekebalan, melindungi serangan kanker, pengobatan asma dan gangguan pernafasan, serta pengobatan gangguan pencernaan.
Kandungan gizi bawang putih :
*.Energi 116,00kal
*.Protein7,00g
*.Lemak 0,30g
*.Karbohidrat 24,60g
*.Kalsium 28,00mg
*.Fosfor 121,00mg
*.Serat 1,10g
*.Besi 0,20m,g
*.Vit A -
*.Vit B1 0.23mg
*.Vit B2 0,08mg
*.Vit C7,00mg
*.Niacin 0,40mg
6. Bit (Beta vulgaris)
Khasiat bit antara lain pengobatan hati dan kantung empedu, penghancur sel tumor atau kanker, mencegah anemia, dan menurunkan kolesterol.
Kandungan gizi bit antara lain:
*.Energi 147,00kal
*.Protein5,40g
*.Lemak 0,30g
*.Karbohidrat 32,60g
*.Kalsium 51,00mg
*.Fosfor 928,00mg
*.Serat 0,80g
*.Besi 3,40m,g
*.Vit A 22700,00 UI
*.Vit B1 0.07mg
*.Vit B2 0,16mg
*.Vit C 80,00mg
*.Niacin 1,50mg
7. Cabai (Capsicum annuum)
Khasiat cabai antara lain pembersih paru, pengobatan bronchitis, pengobatan masuk angin, pengobatan sinusitis, dan asma.
Kandungan gizi cabai antara lain:
*.Energi 31,00kal
*.Protein 7100g
*.Lemak0,30g
*.Karbohidrat 7,30g
*.Kalsium 29,00mg
*.Fosfor 24,00mg
*.Serat 0,30g
*.Besi 0,50m,g
*.Vit A 71,00RE
*.Vit B10.05mg
*.Vit B2 0,03mg
*.Vit C18,00mg
*.Niacin 0,20mg
8. Jagung ( Zen mays lina)
Khasiat jagung antara lain pembangun otot dan tulang, baik untuk otak dan sistem syaraf, mencegah konstipasi, menurunkan risiko kanker dan jantung, mencegah gigi berlubang, serta minyaknya dapat menurunkan kolesterol darah.
Kandungan gizi jagung:
*.Energi 150,00kal
*.Protein 1,600g
*.Lemak 0,60g
*.Karbohidrat 11,40g
*.Kalsium 2,00mg
*.Fosfor 47,00mg
*.Serat 0,40g
*.Besi 0,30m,g
*.Vit A 30,00 RE
*.Vit B1 0.07mg
*.Vit B2 0,04mg
*.Vit C 3,00mg
*.Niacin0,60mg
9. Kecambah (Bean sprouts)
Khasiat kecambah antara lain memperlambat proses penuaan, anti kanker, menambah kesuburan, dan memperlancar pencernaan.
Kandungan gizi pada kecambah antara lain :
*.Energi 50,00kal
*.Protein 5,70g
*.Lemak 0,10g
*.Karbohidrat 10,00g
*.Kalsium 32,00mg
*.Fosfor 96,00mg
*.Serat 0,70g
*.Besi 1,10m,g
*.Vit A1 3.00RE
*.Vit B10.13mg
*.Vit B2 0,15mg
*.Vit C41,00mg
*.Niacin 1,00mg
Selasa, 12 Oktober 2010
Melarikan diri
yang aku tahu hanya caraku
dimana aku tidak bersedih dan menangis
biarlah nanti aku berfikir
selamat pagi buat hatiku
setidaknya hanya itu saja
sampai siang dan malam datang
nanti aku pulang
terlalu lama hatiku ini diam
ketika aku dicambuk dengan tajamnya keadaan
sakit. . . . Sadarku hilang dalam penat
kadang aku bertanya pada orang
kenapa aku ini melarikan diri
tapi tetap mereka diam
apakah aku terlalu egois
menurutku tidak
sepertinya aku bersedih
tapi kenapa aku tidak meneteskan airmata
kenapa. . .Kenapa. . .
Atau mungkin sudah terlalu banyak ku teteskan
dimana aku tidak bersedih dan menangis
biarlah nanti aku berfikir
selamat pagi buat hatiku
setidaknya hanya itu saja
sampai siang dan malam datang
nanti aku pulang
terlalu lama hatiku ini diam
ketika aku dicambuk dengan tajamnya keadaan
sakit. . . . Sadarku hilang dalam penat
kadang aku bertanya pada orang
kenapa aku ini melarikan diri
tapi tetap mereka diam
apakah aku terlalu egois
menurutku tidak
sepertinya aku bersedih
tapi kenapa aku tidak meneteskan airmata
kenapa. . .Kenapa. . .
Atau mungkin sudah terlalu banyak ku teteskan
Rabu, 06 Oktober 2010
Alternative solusi judul
- kontruktivis
- CLIS(children learning in science)
- learning cycle
- STS(science teknology society)
- SETS ( Science environment teknologi society)
- pendekatan interaktif
- pendekatan inquiri
- pendekatan discoveri
- pendekatan lingkungan
- pendekatan tematik
- CTL (contextual teaching and learning)
- cooperative learning (CL)
- CL tipe STAD
- CL tipe Jigsaw
- CL tipe NTH
- media IT
- media komik
- CLIS(children learning in science)
- learning cycle
- STS(science teknology society)
- SETS ( Science environment teknologi society)
- pendekatan interaktif
- pendekatan inquiri
- pendekatan discoveri
- pendekatan lingkungan
- pendekatan tematik
- CTL (contextual teaching and learning)
- cooperative learning (CL)
- CL tipe STAD
- CL tipe Jigsaw
- CL tipe NTH
- media IT
- media komik
Selasa, 05 Oktober 2010
Bertahanlah. . . Jangan menyerah
Ada banyak pertanyaan tentang kemampuan seseorang tapi semua itu hanya keinginan semata. Tetap bertahanlah pada tujuanmu. Semangat
Selasa, 21 September 2010
Kerisauan hati
Ketika kita dihadapkan dalam suatu masalah yang berat kita sering kali mempertanyakan tentang keberadaan tuhan. Tapi jika memang aku tak peduli dengan semuanya dengan berusaha dan berdoa niscaya kita akan berhasil
tentang atom
Atom
Dari Wikipedia bahasa Indonesia, ensiklopedia bebas
| Atom helium | ||||||||
|---|---|---|---|---|---|---|---|---|
| Ilustrasi atom helium yang memperlihatkan inti atom (merah muda) dan distribusi awan elektron (hitam). Inti atom (kanan atas) berbentuk simetris bulat, walaupun untuk inti atom yang lebih rumit ia tidaklah selalu demikian. | ||||||||
| Klasifikasi | ||||||||
| ||||||||
| Sifat-sifat | ||||||||
|
Istilah atom berasal dari Bahasa Yunani (ἄτομος/átomos, α-τεμνω), yang berarti tidak dapat dipotong ataupun sesuatu yang tidak dapat dibagi-bagi lagi. Konsep atom sebagai komponen yang tak dapat dibagi-bagi lagi pertama kali diajukan oleh para filsuf India dan Yunani. Pada abad ke-17 dan ke-18, para kimiawan meletakkan dasar-dasar pemikiran ini dengan menunjukkan bahwa zat-zat tertentu tidak dapat dibagi-bagi lebih jauh lagi menggunakan metode-metode kimia. Selama akhir abad ke-19 dan awal abad ke-20, para fisikawan berhasil menemukan struktur dan komponen-komponen subatom di dalam atom, membuktikan bahwa 'atom' tidaklah tak dapat dibagi-bagi lagi. Prinsip-prinsip mekanika kuantum yang digunakan para fisikawan kemudian berhasil memodelkan atom.[1]
Dalam pengamatan sehari-hari, secara relatif atom dianggap sebuah objek yang sangat kecil yang memiliki massa yang secara proporsional kecil pula. Atom hanya dapat dipantau dengan menggunakan peralatan khusus seperti mikroskop gaya atom. Lebih dari 99,9% massa atom berpusat pada inti atom,[catatan 1] dengan proton dan neutron yang bermassa hampir sama. Setiap unsur paling tidak memiliki satu isotop dengan inti yang tidak stabil, yang dapat mengalami peluruhan radioaktif. Hal ini dapat mengakibatkan transmutasi, yang mengubah jumlah proton dan neutron pada inti.[2] Elektron yang terikat pada atom mengandung sejumlah aras energi, ataupun orbital, yang stabil dan dapat mengalami transisi di antara aras tersebut dengan menyerap ataupun memancarkan foton yang sesuai dengan perbedaan energi antara aras. Elektron pada atom menentukan sifat-sifat kimiawi sebuah unsur, dan mempengaruhi sifat-sifat magnetis atom tersebut.
Daftar isi[sembunyikan] |
[sunting] Sejarah
Konsep bahwa materi terdiri dari satuan-satuan terpisah yang tidak dapat dibagi lagi menjadi satuan yang lebih kecil telah ada selama satu milenium. Namun, pemikiran tersebut masihlah bersifat abstrak dan filosofis, daripada berdasarkan pengamatan empiris dan eksperimen. Secara filosofis, deskripsi sifat-sifat atom bervariasi tergantung pada budaya dan aliran filosofi tersebut, dan seringkali pula mengandung unsur-unsur spiritual di dalamnya. Walaupun demikian, pemikiran dasar mengenai atom dapat diterima oleh para ilmuwan ribuan tahun kemudian, karena ia secara elegan dapat menjelaskan penemuan-penemuan baru pada bidang kimia.[3]Rujukan paling awal mengenai konsep atom dapat ditilik kembali kepada zaman India kuno pada tahun 800 sebelum masehi,[4] yang dijelaskan dalam naskah filsafat Jainisme sebagai anu dan paramanu.[4][5] Aliran mazhab Nyaya dan Vaisesika mengembangkan teori yang menjelaskan bagaimana atom-atom bergabung menjadi benda-benda yang lebih kompleks.[6] Satu abad kemudian muncul rujukan mengenai atom di dunia Barat oleh Leukippos, yang kemudian oleh muridnya Demokritos pandangan tersebut disistematiskan. Kira-kira pada tahun 450 SM, Demokritos menciptakan istilah átomos (bahasa Yunani: ἄτομος), yang berarti "tidak dapat dipotong" ataupun "tidak dapat dibagi-bagi lagi". Teori Demokritos mengenai atom bukanlah usaha untuk menjabarkan suatu fenomena fisis secara rinci, melainkan suatu filosofi yang mencoba untuk memberikan jawaban atas perubahan-perubahan yang terjadi pada alam.[1] Filosofi serupa juga terjadi di India, namun demikian ilmu pengetahuan modern memutuskan untuk menggunakan istilah "atom" yang dicetuskan oleh Demokritos.[3]
Kemajuan lebih jauh pada pemahaman mengenai atom dimulai dengan berkembangnya ilmu kimia. Pada tahun 1661, Robert Boyle mempublikasikan buku The Sceptical Chymist yang berargumen bahwa materi-materi di dunia ini terdiri dari berbagai kombinasi "corpuscules", yaitu atom-atom yang berbeda. Hal ini berbeda dengan pandangan klasik yang berpendapat bahwa materi terdiri dari unsur-unsur udara, tanah, api, dan air.[7] Pada tahun 1789, istilah element (unsur) didefinisikan oleh seorang bangsawan dan peneliti Perancis, Antoine Lavoisier, sebagai bahan dasar yang tidak dapat dibagi-bagi lebih jauh lagi dengan menggunakan metode-metode kimia.[8]

Berbagai atom dan molekul yang digambarkan pada buku John Dalton, A New System of Chemical Philosophy (1808).
Teori partikel ini kemudian dikonfirmasikan lebih jauh lagi pada tahun 1827, yaitu ketika botaniwan Robert Brown menggunakan mikroskop untuk mengamati debu-debu yang mengambang di atas air dan menemukan bahwa debu-debu tersebut bergerak secara acak. Fenomena ini kemudian dikenal sebagai "Gerak Brown". Pada tahun 1877, J. Desaulx mengajukan pendapat bahwa fenomena ini disebabkan oleh gerak termal molekul air, dan pada tahun 1905 Albert Einstein membuat analisis matematika terhadap gerak ini.[11][12][13] Fisikawan Perancis Jean Perrin kemudian menggunakan hasil kerja Einstein untuk menentukan massa dan dimensi atom secara eksperimen, yang kemudian dengan pasti menjadi verifikasi atas teori atom Dalton.[14]
Berdasarkan hasil penelitiannya terhadap sinar katoda, pada tahun 1897 J. J. Thomson menemukan elektron dan sifat-sifat subatomiknya. Hal ini meruntuhkan konsep atom sebagai satuan yang tidak dapat dibagi-bagi lagi.[15] Thomson percaya bahwa elektron-elektron terdistribusi secara merata di seluruh atom, dan muatan-muatannya diseimbangkan oleh keberadaan lautan muatan positif (model puding prem).
Namun pada tahun 1909, para peneliti di bawah arahan Ernest Rutherford menembakkan ion helium ke lembaran tipis emas, dan menemukan bahwa sebagian kecil ion tersebut dipantulkan dengan sudut pantulan yang lebih tajam dari yang apa yang diprediksikan oleh teori Thomson. Rutherford kemudian mengajukan pendapat bahwa muatan positif suatu atom dan kebanyakan massanya terkonsentrasi pada inti atom, dengan elektron yang mengitari inti atom seperti planet mengitari matahari. Muatan positif ion helium yang melewati inti padat ini haruslah dipantulkan dengan sudut pantulan yang lebih tajam. Pada tahun 1913, ketika bereksperimen dengan hasil proses peluruhan radioaktif, Frederick Soddy menemukan bahwa terdapat lebih dari satu jenis atom pada setiap posisi tabel periodik.[16] Istilah isotop kemudian diciptakan oleh Margaret Todd sebagai nama yang tepat untuk atom-atom yang berbeda namun merupakan satu unsur yang sama. J.J. Thomson selanjutnya menemukan teknik untuk memisahkan jenis-jenis atom tersebut melalui hasil kerjanya pada gas yang terionisasi.[17]
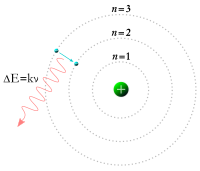
Model atom hidrogen Bohr yang menunjukkan loncatan elektron antara orbit-orbit tetap dan memancarkan energi foton dengan frekuensi tertentu.
Ikatan kimia antar atom kemudian pada tahun 1916 dijelaskan oleh Gilbert Newton Lewis sebagai interaksi antara elektron-elektron atom tersebut.[20] Atas adanya keteraturan sifat-sifat kimiawi dalam tabel periode kimia,[21] kimiawan Amerika Irving Langmuir tahun 1919 berpendapat bahwa hal ini dapat dijelaskan apabila elektron-elektron pada sebuah atom saling berhubungan atau berkumpul dalam bentuk-bentuk tertentu. Sekelompok elektron diperkirakan menduduki satu set kelopak elektron di sekitar inti atom.
Percobaan Stern-Gerlach pada tahun 1922 memberikan bukti lebih jauh mengenai sifat-sifat kuantum atom. Ketika seberkas atom perak ditembakkan melalui medan magnet, berkas tersebut terpisah-pisah sesuai dengan arah momentum sudut atom (spin). Oleh karena arah spin adalah acak, berkas ini diharapkan menyebar menjadi satu garis. Namun pada kenyataannya berkas ini terbagi menjadi dua bagian, tergantung dari apakah spin atom tersebut berorientasi ke atas ataupun ke bawah.[22]
Pada tahun 1926, dengan menggunakan pemikiran Louis de Broglie bahwa partikel berperilaku seperti gelombang, Erwin Schrödinger mengembangkan suatu model atom matematis yang menggambarkan elektron sebagai gelombang tiga dimensi daripada sebagai titik-titik partikel. Konsekuensi penggunaan bentuk gelombang untuk menjelaskan elektron ini adalah bahwa adalah tidak mungkin untuk secara matematis menghitung posisi dan momentum partikel secara bersamaan. Hal ini kemudian dikenal sebagai prinsip ketidakpastian, yang dirumuskan oleh Werner Heisenberg pada 1926. Menurut konsep ini, untuk setiap pengukuran suatu posisi, seseorang hanya bisa mendapatkan kisaran nilai-nilai probabilitas momentum, demikian pula sebaliknya. Walaupun model ini sulit untuk divisualisasikan, ia dapat dengan baik menjelaskan sifat-sifat atom yang terpantau yang sebelumnya tidak dapat dijelaskan oleh teori mana pun. Oleh sebab itu, model atom yang menggambarkan elektron mengitari inti atom seperti planet mengitari matahari digugurkan dan digantikan oleh model orbital atom di sekitar inti di mana elektron paling berkemungkinan berada.[23][24]
Perkembangan pada spektrometri massa mengijinkan dilakukannya pengukuran massa atom secara tepat. Peralatan spektrometer ini menggunakan magnet untuk membelokkan trayektori berkas ion, dan banyaknya defleksi ditentukan dengan rasio massa atom terhadap muatannya. Kimiawan Francis William Aston menggunakan peralatan ini untuk menunjukkan bahwa isotop mempunyai massa yang berbeda. Perbedaan massa antar isotop ini berupa bilangan bulat, dan ia disebut sebagai kaidah bilangan bulat.[25] Penjelasan pada perbedaan massa isotop ini berhasil dipecahkan setelah ditemukannya neutron, suatu partikel bermuatan netral dengan massa yang hampir sama dengan proton, yaitu oleh James Chadwick pada tahun 1932. Isotop kemudian dijelaskan sebagai unsur dengan jumlah proton yang sama, namun memiliki jumlah neutron yang berbeda dalam inti atom.[26]
Pada tahun 1950-an, perkembangan pemercepat partikel dan detektor partikel mengijinkan para ilmuwan mempelajari dampak-dampak dari atom yang bergerak dengan energi yang tinggi.[27] Neutron dan proton kemudian diketahui sebagai hadron, yaitu komposit partikel-partikel kecil yang disebut sebagai kuark. Model-model standar fisika nuklir kemudian dikembangkan untuk menjelaskan sifat-sifat inti atom dalam hal interaksi partikel subatom ini.[28]
Sekitar tahun 1985, Steven Chu dkk. di Bell Labs mengembangkan sebuah teknik untuk menurunkan temperatur atom menggunakan laser. Pada tahun yang sama, sekelompok ilmuwan yang diketuai oleh William D. Phillips berhasil memerangkap atom natrium dalam perangkap magnet. Claude Cohen-Tannoudji kemudian menggabungkan kedua teknik tersebut untuk mendinginkan sejumlah kecil atom sampai beberapa mikrokelvin. Hal ini mengijinkan ilmuwan mempelajari atom dengan presisi yang sangat tinggi, yang pada akhirnya membawa para ilmuwan menemukan kondensasi Bose-Einstein.[29]
Dalam sejarahnya, sebuah atom tunggal sangatlah kecil untuk digunakan dalam aplikasi ilmiah. Namun baru-baru ini, berbagai peranti yang menggunakan sebuah atom tunggal logam yang dihubungkan dengan ligan-ligan organik (transistor elektron tunggal) telah dibuat.[30] Berbagai penelitian telah dilakukan untuk memerangkap dan memperlambat laju atom menggunakan pendinginan laser untuk mendapatkan pemahaman yang lebih baik mengenai sifat-sifat atom.[31]
[sunting] Komponen-komponen atom
[sunting] Partikel subatom
Dari kesemua partikel subatom ini, elektron adalah yang paling ringan, dengan massa elektron sebesar 9,11 × 10−31 kg dan mempunyai muatan negatif. Ukuran elektron sangatlah kecil sedemikiannya tiada teknik pengukuran yang dapat digunakan untuk mengukur ukurannya.[32] Proton memiliki muatan positif dan massa 1.836 kali lebih berat daripada elektron (1,6726 × 10−27 kg). Neutron tidak bermuatan listrik dan bermassa bebas 1.839 kali massa elektron[33] atau (1,6929 × 10−27 kg).
Dalam model standar fisika, baik proton dan neutron terdiri dari partikel elementer yang disebut kuark. Kuark termasuk kedalam golongan partikel fermion dan merupakan salah satu dari dua bahan penyusun materi dasar (yang lainnya adalah lepton). Terdapat enam jenis kuark dan tiap-tiap kuark tersebut memiliki muatan listri fraksional sebesar +2/3 ataupun −1/3. Proton terdiri dari dua kuark naik dan satu kuark turun, manakala neutron terdiri dari satu kuark naik dan dua kuark turun. Perbedaan komposisi kuark ini mempengaruhi perbedaan massa dan muatan antara dua partikel tersebut. Kuark terikat bersama oleh gaya nuklir kuat yang diperantarai oleh gluon. Gluon adalah anggota dari boson tolok yang merupakan perantara gaya-gaya fisika.[34][35]
[sunting] Inti atom
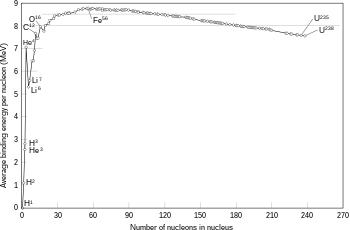
Energi pengikatan yang diperlukan oleh nukleon untuk lolos dari inti pada berbagai isotop.
![\begin{smallmatrix}1,07 \sqrt[3]{A}\end{smallmatrix}](http://upload.wikimedia.org/math/b/5/6/b56e16e37f6036d3414eaf3c1d299f8a.png) fm, dengan A adalah jumlah nukleon.[37] Hal ini sangatlah kecil dibandingkan dengan jari-jari atom. Nukleon-nukleon tersebut terikat bersama oleh gaya tarik-menarik potensial yang disebut gaya kuat residual. Pada jarak lebih kecil daripada 2,5 fm, gaya ini lebih kuat daripada gaya elektrostatik yang menyebabkan proton saling tolak menolak.[38]
fm, dengan A adalah jumlah nukleon.[37] Hal ini sangatlah kecil dibandingkan dengan jari-jari atom. Nukleon-nukleon tersebut terikat bersama oleh gaya tarik-menarik potensial yang disebut gaya kuat residual. Pada jarak lebih kecil daripada 2,5 fm, gaya ini lebih kuat daripada gaya elektrostatik yang menyebabkan proton saling tolak menolak.[38]Atom dari unsur kimia yang sama memiliki jumlah proton yang sama, disebut nomor atom. Suatu unsur dapat memiliki jumlah neutron yang bervariasi. Variasi ini disebut sebagai isotop. Jumlah proton dan neutron suatu atom akan menentukan nuklida atom tersebut, sedangkan jumlah neutron relatif terhadap jumlah proton akan menentukan stabilitas inti atom, dengan isotop unsur tertentu akan menjalankan peluruhan radioaktif.[39]
Neutron dan proton adalah dua jenis fermion yang berbeda. Asas pengecualian Pauli melarang adanya keberadaan fermion yang identik (seperti misalnya proton berganda) menduduki suatu keadaan fisik kuantum yang sama pada waktu yang sama. Oleh karena itu, setiap proton dalam inti atom harusnya menduduki keadaan kuantum yang berbeda dengan aras energinya masing-masing. Asas Pauli ini juga berlaku untuk neutron. Pelarangan ini tidak berlaku bagi proton dan neutron yang menduduki keadaan kuantum yang sama.[40]
Untuk atom dengan nomor atom yang rendah, inti atom yang memiliki jumlah proton lebih banyak daripada neutron berpotensi jatuh ke keadaan energi yang lebih rendah melalui peluruhan radioaktif yang menyebabkan jumlah proton dan neutron seimbang. Oleh karena itu, atom dengan jumlah proton dan neutron yang berimbang lebih stabil dan cenderung tidak meluruh. Namun, dengan meningkatnya nomor atom, gaya tolak-menolak antar proton membuat inti atom memerlukan proporsi neutron yang lebih tinggi lagi untuk menjaga stabilitasnya. Pada inti yang paling berat, rasio neutron per proton yang diperlukan untuk menjaga stabilitasnya akan meningkat menjadi 1,5.[40]
Jika massa inti setelah terjadinya reaksi fusi lebih kecil daripada jumlah massa partikel awal penyusunnya, maka perbedaan ini disebabkan oleh pelepasan pancaran energi (misalnya sinar gamma), sebagaimana yang ditemukan pada rumus kesetaraan massa-energi Einstein, E = mc2, dengan m adalah massa yang hilang dan c adalah kecepatan cahaya. Defisit ini merupakan bagian dari energi pengikatan inti yang baru.[44]
Fusi dua inti yang menghasilkan inti yang lebih besar dengan nomor atom lebih rendah daripada besi dan nikel (jumlah total nukleon sama dengan 60) biasanya bersifat eksotermik, yang berarti bahwa proses ini melepaskan energi.[45] Adalah proses pelepasan energi inilah yang membuat fusi nuklir pada bintang dapat dipertahankan. Untuk inti yang lebih berat, energi pengikatan per nukleon dalam inti mulai menurun. Ini berarti bahwa proses fusi akan bersifat endotermik.[40]
[sunting] Awan elektron
Elektron, sama seperti partikel lainnya, memiliki sifat seperti partikel maupun seperti gelombang (dualisme gelombang-partikel). Awan elektron adalah suatu daerah dalam sumur potensi di mana tiap-tiap elektron menghasilkan sejenis gelombang diam (yaitu gelombang yang tidak bergerak relatif terhadap inti) tiga dimensi. Perilaku ini ditentukan oleh orbital atom, yakni suatu fungsi matematika yang menghitung probabilitas suatu elektron akan muncul pada suatu lokasi tertentu ketika posisinya diukur.[46] Hanya akan ada satu himpunan orbital tertentu yang berada disekitar inti, karena pola-pola gelombang lainnya akan dengan cepat meluruh menjadi bentuk yang lebih stabil.[47]
Energi yang diperlukan untuk melepaskan ataupun menambah satu elektron (energi pengikatan elektron) adalah lebih kecil daripada energi pengikatan nukleon. Sebagai contohnya, hanya diperlukan 13,6 eV untuk melepaskan elektron dari atom hidrogen.[48] Bandingkan dengan energi sebesar 2,3 MeV yang diperlukan untuk memecah inti deuterium.[49] Atom bermuatan listrik netral oleh karena jumlah proton dan elektronnya yang sama. Atom yang kekurangan ataupun kelebihan elektron disebut sebagai ion. Elektron yang terletak paling luar dari inti dapat ditransfer ataupun dibagi ke atom terdekat lainnya. Dengan cara inilah, atom dapat saling berikatan membentuk molekul.[50]
[sunting] Sifat-sifat
[sunting] Sifat-sifat nuklir
Berdasarkan definisi, dua atom dengan jumlah proton yang identik dalam intinya termasuk ke dalam unsur kimia yang sama. Atom dengan jumlah proton sama namun dengan jumlah neutron berbeda adalah dua isotop berbeda dari satu unsur yang sama. Sebagai contohnya, semua hidrogen memiliki satu proton, namun terdapat satu isotop hidrogen yang tidak memiliki neutron (hidrogen-1), satu isotop yang memiliki satu neutron (deuterium), dua neutron (tritium), dll. Hidrogen-1 adalah bentuk isotop hidrogen yang paling umum. Kadang-kadang ia disebut sebagai protium.[51] Semua isotop unsur yang bernomor atom lebih besar daripada 82 bersifat radioaktif.[52][53]Dari sekitar 339 nuklida yang terbentuk secara alami di Bumi, 269 di antaranya belum pernah terpantau meluruh.[54] Pada unsur kimia, 80 dari unsur yang diketahui memiliki satu atau lebih isotop stabil. Unsur 43, 63, dan semua unsur lebih tinggi dari 83 tidak memiliki isotop stabil. Dua puluh tujuh unsur hanya memiliki satu isotop stabil, manakala jumlah isotop stabil yang paling banyak terpantau pada unsur timah dengan 10 jenis isotop stabil.[55]
[sunting] Massa
Karena mayoritas massa atom berasal dari proton dan neutron, jumlah keseluruhan partikel ini dalam atom disebut sebagai nomor massa. Massa atom pada keadaan diam sering diekspresikan menggunakan satuan massa atom (u) yang juga disebut dalton (Da). Satuan ini didefinisikan sebagai seperduabelas massa atom karbon-12 netral, yang kira-kira sebesar 1,66 × 10−27 kg.[56] Hidrogen-1 yang merupakan isotop teringan hidrogen memiliki bobot atom 1,007825 u.[57] Atom memiliki massa yang kira-kira sama dengan nomor massanya dikalikan satuan massa atom.[58] Atom stabil yang paling berat adalah timbal-208,[52] dengan massa sebesar 207,9766521 u.[59]Para kimiawan biasanya menggunakan satuan mol untuk menyatakan jumlah atom. Satu mol didefinisikan sebagai jumlah atom yang terdapat pada 12 gram persis karbon-12. Jumlah ini adalah sekitar 6,022 × 1023, yang dikenal pula dengan nama tetapan Avogadro. Dengan demikian suatu unsur dengan massa atom 1 u akan memiliki satu mol atom yang bermassa 0,001 kg. Sebagai contohnya, Karbon memiliki massa atom 12 u, sehingga satu mol karbon atom memiliki massa 0,012 kg.[56]
[sunting] Ukuran
Ukuran atom sangatlah kecil, sedemikian kecilnya lebar satu helai rambut dapat menampung sekitar 1 juta atom karbon.[63] Satu tetes air pula mengandung sekitar 2 × 1021 atom oksigen.[64] Intan satu karat dengan massa 2 × 10-4 kg mengandung sekitar 1022 atom karbon.[catatan 2] Jika sebuah apel diperbesar sampai seukuran besarnya Bumi, maka atom dalam apel tersebut akan terlihat sebesar ukuran apel awal tersebut.[65]
[sunting] Peluruhan radioaktif
Bentuk-bentuk peluruhan radioaktif yang paling umum adalah:[67][68]
- Peluruhan alfa, terjadi ketika suatu inti memancarkan partikel alfa (inti helium yang terdiri dari dua proton dan dua neutron). Hasil peluruhan ini adalah unsur baru dengan nomor atom yang lebih kecil.
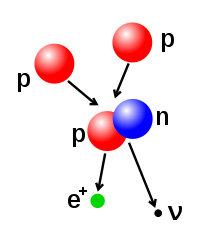
- Peluruhan beta, diatur oleh gaya lemah, dan dihasilkan oleh transformasi neutron menjadi proton, ataupun proton menjadi neutron. Transformasi neutron menjadi proton akan diikuti oleh emisi satu elektron dan satu antineutrino, manakala transformasi proton menjadi neutron diikuti oleh emisi satu positron dan satu neutrino. Emisi elektron ataupun emisi positron disebut sebagai partikel beta. Peluruhan beta dapat meningkatkan maupun menurunkan nomor atom inti sebesar satu.
- Peluruhan gama, dihasilkan oleh perubahan pada aras energi inti ke keadaan yang lebih rendah, menyebabkan emisi radiasi elektromagnetik. Hal ini dapat terjadi setelah emisi partikel alfa ataupun beta dari peluruhan radioaktif.
Tiap-tiap isotop radioaktif mempunyai karakteristik periode waktu peluruhan (waktu paruh) yang merupakan lamanya waktu yang diperlukan oleh setengah jumlah sampel untuk meluruh habis. Proses peluruhan bersifat eksponensial, sehingga setelah dua waktu paruh, hanya akan tersisa 25% isotop.[66]
[sunting] Momen magnetik
Setiap partikel elementer mempunyai sifat mekanika kuantum intrinsik yang dikenal dengan nama spin. Spin beranalogi dengan momentum sudut suatu objek yang berputar pada pusat massanya, walaupun secara kaku partikel tidaklah berperilaku seperti ini. Spin diukur dalam satuan tetapan Planck tereduksi (ħ), dengan elektron, proton, dan neutron semuanya memiliki spin ½ ħ, atau "spin-½". Dalam atom, elektron yang bergerak di sekitar inti atom selain memiliki spin juga memiliki momentum sudut orbital, manakala inti atom memiliki momentum sudut pula oleh karena spin nuklirnya sendiri.[69]Medan magnet yang dihasilkan oleh suatu atom (disebut momen magnetik) ditentukan oleh kombinasi berbagai macam momentum sudut ini. Namun, kontribusi yang terbesar tetap berasal dari spin. Oleh karena elektron mematuhi asas pengecualian Pauli, yakni tiada dua elektron yang dapat ditemukan pada keadaan kuantum yang sama, pasangan elektron yang terikat satu sama lainnya memiliki spin yang berlawanan, dengan satu berspin naik, dan yang satunya lagi berspin turun. Kedua spin yang berlawanan ini akan saling menetralkan, sehingga momen dipol magnetik totalnya menjadi nol pada beberapa atom berjumlah elektron genap.[70]
Pada atom berelektron ganjil seperti besi, adanya keberadaan elektron yang tak berpasangan menyebabkan atom tersebut bersifat feromagnetik. Orbital-orbital atom di sekeliling atom tersebut saling bertumpang tindih dan penurunan keadaan energi dicapai ketika spin elektron yang tak berpasangan tersusun saling berjajar. Proses ini disebut sebagai interaksi pertukaran. Ketika momen magnetik atom feromagnetik tersusun berjajaran, bahan yang tersusun oleh atom ini dapat menghasilkan medan makroskopis yang dapat dideteksi. Bahan-bahan yang bersifat paramagnetik memiliki atom dengan momen magnetik yang tersusun acak, sehingga tiada medan magnet yang dihasilkan. Namun, momen magnetik tiap-tiap atom individu tersebut akan tersusun berjajar ketika diberikan medan magnet.[70][71]
Inti atom juga dapat memiliki spin. Biasanya spin inti tersusun secara acak oleh karena kesetimbangan termal. Namun, untuk unsur-unsur tertentu (seperti xenon-129), adalah mungkin untuk memolarisasi keadaan spin nuklir secara signifikan sehingga spin-spin tersebut tersusun berjajar dengan arah yang sama. Kondisi ini disebut sebagai hiperpolarisasi. Fenomena ini memiliki aplikasi yang penting dalam pencitraan resonansi magnetik.[72][73]
[sunting] Aras-aras energi
Ketika suatu elektron terikat pada sebuah atom, ia memiliki energi potensial yang berbanding terbalik terhadap jarak elektron terhadap inti. Hal ini diukur oleh besarnya energi yang diperlukan untuk melepaskan elektron dari atom dan biasanya diekspresikan dengan satuan elektronvolt (eV). Dalam model mekanika kuantum, elektron-elektron yang terikat hanya dapat menduduki satu set keadaan yang berpusat pada inti, dan tiap-tiap keadaan berkorespondensi terhadap aras energi tertentu. Keadaan energi terendah suatu elektron yang terikat disebut sebagai keadaan dasar, manakala keadaan energi yang lebih tinggi disebut sebagai keadaan tereksitasi.[74]Agar suatu elektron dapat meloncat dari satu keadaan ke keadaan lainnya, ia haruslah menyerap ataupun memancarkan foton pada energi yang sesuai dengan perbedaan energi potensial antar dua aras tersebut. Energi foton yang dipancarkan adalah sebanding dengan frekuensinya.[75] Tiap-tiap unsur memiliki spektrum karakteristiknya masing-masing. Hal ini bergantung pada muatan inti, subkelopak yang terisi dengan elektron, interaksi elektromagnetik antar elektron, dan faktor-faktor lainnya.[76]
Ketika suatu spektrum energi yang berkelanjutan dipancarkan melalui suatu gas ataupun plasma, beberapa foton diserap oleh atom, menyebabkan elektron berpindah aras energi. Elektron yang tereksitasi akan secara spontan memancarkan energi ini sebagai foton dan jatuh kembali ke aras energi yang lebih rendah. Oleh karena itu, atom berperilaku seperti bahan penyaring yang akan membentuk sederetan pita absorpsi. Pengukuran spektroskopi terhadap kekuatan dan lebar pita spektrum mengijinkan penentuan komposisi dan sifat-sifat fisika suatu zat.[77]
Pemantauan cermat pada garis-garis spektrum menunjukkan bahwa beberapa memperlihatkan adanya pemisahan halus. Hal ini terjadi karena kopling spin-orbit yang merupakan interaksi antara spin dengan gerak elektron terluar.[78] Ketika suatu atom berada dalam medan magnet eksternal, garis-garis spektrum terpisah menjadi tiga atau lebih komponen. Hal ini disebut sebagai efek Zeeman. Efek Zeeman disebabkan oleh interaksi medan magnet dengan momen magnetik atom dan elektronnya. Beberapa atom dapat memiliki banyak konfigurasi elektron dengan aras energi yang sama, sehingga akan tampak sebagai satu garis spektrum. Interaksi medan magnet dengan atom akan menggeser konfigurasi-konfigurasi elektron menuju aras energi yang sedikit berbeda, menyebabkan garis spektrum berganda.[79] Keberadaan medan listrik eksternal dapat menyebabkan pemisahan dan pergeseran garis spektrum dengan mengubah aras energi elektron. Fenomena ini disebut sebagai efek Stark.[80]
[sunting] Valensi dan perilaku ikatan
Kelopak atau kulit elektron terluar suatu atom dalam keadaan yang tak terkombinasi disebut sebagai kelopak valensi dan elektron dalam kelopak tersebut disebut elektron valensi. Jumlah elektron valensi menentukan perilaku ikatan atom tersebut dengan atom lainnya. Atom cenderung bereaksi dengan satu sama lainnya melalui pengisian (ataupun pengosongan) elektron valensi terluar atom.[81] Ikatan kimia dapat dilihat sebagai transfer elektron dari satu atom ke atom lainnya, seperti yang terpantau pada natrium klorida dan garam-garam ionik lainnya. Namun, banyak pula unsur yang menunjukkan perilaku valensi berganda, atau kecenderungan membagi elektron dengan jumlah yang berbeda pada senyawa yang berbeda. Sehingga, ikatan kimia antara unsur-unsur ini cenderung berupa pembagian elektron daripada transfer elektron. Contohnya meliputi unsur karbon dalam senyawa organik.[82]Unsur-unsur kimia sering ditampilkan dalam tabel periodik yang menampilkan sifat-sifat kimia suatu unsur yang berpola. Unsur-unsur dengan jumlah elektron valensi yang sama dikelompokkan secara vertikel (disebut golongan). Unsur-unsur pada bagian terkanan tabel memiliki kelopak terluarnya terisi penuh, menyebabkan unsur-unsur tersebut cenderung bersifat inert (gas mulia).[83][84]
[sunting] Keadaan

Gambaran pembentukan kondensat Bose-Einstein.
Pada suhu mendekati nol mutlak, atom dapat membentuk kondensat Bose-Einstein, di mana efek-efek mekanika kuantum yang biasanya hanya terpantau pada skala atom terpantau secara makroskopis.[87][88] Kumpulan atom-atom yang dilewat-dinginkan ini berperilaku seperti satu atom super.[89]
[sunting] Identifikasi
Mikroskop penerowongan payaran (scanning tunneling microscope) adalah suatu mikroskop yang digunakan untuk melihat permukaan suatu benda pada tingkat atom. Alat ini menggunakan fenomena penerowongan kuantum yang mengijinkan partikel-partikel menembus sawar yang biasanya tidak dapat dilewati.Sebuah atom dapat diionisasi dengan melepaskan satu elektronnya. Muatan yang ada menyebabkan trayektori atom melengkung ketika ia melalui sebuah medan magnet. Jari-jari trayektori ion tersebut ditentukan oleh massa atom. Spektrometer massa menggunakan prinsip ini untuk menghitung rasio massa terhadap muatan ion. Apabila sampel tersebut mengandung sejumlah isotop, spektrometer massa dapat menentukan proporsi tiap-tiap isotop dengan mengukur intensitas berkas ion yang berbeda. Teknik untuk menguapkan atom meliputi spektroskopi emisi atomik plasma gandeng induktif (inductively coupled plasma atomic emission spectroscopy) dan spektrometri massa plasma gandeng induktif (inductively coupled plasma mass spectrometry), keduanya menggunakan plasma untuk menguapkan sampel analisis.[90]
Metode lainnya yang lebih selektif adalah spektroskopi pelepasan energi elektron (electron energy loss spectroscopy), yang mengukur pelepasan energi berkas elektron dalam suatu mikroskop elektron transmisi ketika ia berinteraksi dengan sampel. Tomografi kuar atom memiliki resolusi sub-nanometer dalam 3-D dan dapat secara kimiawi mengidentifikasi atom-atom individu menggunakan spektrometri massa waktu lintas.[91]
Spektrum keadaan tereksitasi dapat digunakan untuk menganalisa komposisi atom bintang yang jauh. Panjang gelombang cahaya tertentu yang dipancarkan oleh bintang dapat dipisahkan dan dicocokkan dengan transisi terkuantisasi atom gas bebas. Warna bintang kemudian dapat direplikasi menggunakan lampu lucutan gas yang mengandung unsur yang sama.[92] Helium pada Matahari ditemukan dengan menggunakan cara ini 23 tahun sebelum ia ditemukan di Bumi.[93]
[sunting] Asal usul dan kondisi sekarang
Atom menduduki sekitar 4% densitas energi total yang ada dalam alam semesta terpantau, dengan densitas rata-rata sekitar 0,25 atom/m3.[94] Dalam galaksi Bima Sakti, atom memiliki konsentrasi yang lebih tinggi, dengan densitas materi dalam medium antarbintang berkisar antara 105 sampai dengan 109 atom/m3.[95] Matahari sendiri dipercayai berada dalam Gelembung Lokal, yaitu suatu daerah yang mengandung banyak gas ion, sehingga densitas di sekelilingnya adalah sekitar 103 atom/m3.[96] Bintang membentuk awan-awan padat dalam medium antarbintang, dan proses evolusioner bintang akan menyebabkan peningkatan kandungan unsur yang lebih berat daripada hidrogen dan helium dalam medium antarbintang. Sampai dengan 95% atom Bima Sakti terkonsentrasi dalam bintang-bintang, dan massa total atom ini membentuk sekitar 10% massa galaksi.[97] Massa sisanya adalah materi gelap yang tidak diketahui dengan jelas.[98][sunting] Nukleosintesis
Isotop seperti litium-6 dihasilkan di ruang angkasa melalui spalasi sinar kosmis.[104] Hal ini terjadi ketika sebuah proton berenergi tinggi menumbuk inti atom, menyebabkan sejumlah besar nukleon berhamburan. Unsur yang lebih berat daripada besi dihasilkan di supernova melalui proses r dan di bintang-bintang AGB melalui proses s. Kedua-duanya melibatkan penangkapan neutron oleh inti atom.[105] Unsur-unsur seperti timbal kebanyakan dibentuk melalui peluruhan radioaktif unsur-unsur lain yang lebih berat.[106]
[sunting] Bumi
Kebanyakan atom yang menyusun Bumi dan termasuk pula seluruh makhluk hidupnya pernah berada dalam bentuk yang sekarang di nebula yang runtuh dari awan molekul dan membentuk Tata Surya. Sisanya merupakan akibat dari peluruhan radioaktif dan proporsinya dapat digunakan untuk menentukan usia Bumi melalui penanggalan radiometrik.[107][108] Kebanyakan helium dalam kerak Bumi merupakan produk peluruhan alfa.[109]Terdapat sekelumit atom di Bumi yang pada awal pembentukannya tidak ada dan juga bukan merupakan akibat dari peluruhan radioaktif. Karbon-14 secara berkesinambungan dihasilkan oleh sinar kosmik di atmosfer.[110] Beberapa atom di Bumi secara buatan dihasilkan oleh reaktor ataupun senjata nuklir.[111][112] Dari semua Unsur-unsur transuranium yang bernomor atom lebih besar daripada 92, hanya plutonium dan neptunium sajalah yang terdapat di Bumi secara alami.[113][114] Unsur-unsur transuranium memiliki waktu paruh radioaktif yang lebih pendek daripada umur Bumi[115], sehingga unsur-unsur ini telah lama meluruh. Pengecualian terdapat pada plutonium-244 yang kemungkinan tersimpan dalam debu kosmik.[107] Kandungan alami plutonium dan neptunium dihasilkan dari penangkapan neutron dalam bijih uranium.[116]
Bumi mengandung sekitar 1,33 × 1050 atom.[117] Pada atmosfer planet, terdapat sejumlah kecil atom gas mulia seperti argon dan neon. Sisa 99% atom pada atmosfer bumi terikat dalam bentuk molekul, misalnya karbon dioksida, oksigen diatomik, dan nitrogen diatomik. Pada permukaan Bumi, atom-atom saling berikatan membentuk berbagai macam senyawa, meliputi air, garam, silikat, dan oksida. Atom juga dapat bergabung membentuk bahan-bahan yang tidak terdiri dari molekul, contohnya kristal dan logam padat ataupun cair.[118][119]
[sunting] Bentuk teoritis dan bentuk langka

Pencitraan 3-Dimensi keberadaan "Pulau stabilitas" di bagian paling kanan
Tiap-tiap partikel materi memiliki partikel antimaterinya masing-masing dengan muatan listrik yang berlawanan. Sehingga, positron adalah antielektron yang bermuatan positif, dan antiproton adalah proton yang bermuatan negatif, Ketika materi dan antimateri bertemu, keduanya akan saling memusnahkan. Terdapat ketidakseimbangan antara jumlah partikel materi dan antimateri. Ketidakseimbangan ini masih belum dipahami secara menyeluruh, walaupun terdapat teori bariogenesis yang memberikan penjelasan yang memungkinkan. Antimateri tidak pernah ditemukan secara alami.[122][123] Namun, pada tahun 1996, antihidrogen berhasil disintesis di laboratorium CERN di Jenewa.[124][125]
Terdapat pula atom-atom langka lainnya yang dibuat dengan menggantikan satu proton, neutron, ataupun elektron dengan partikel lain yang bermuatan sama. Sebagai contoh, elektron dapat digantikan dengan muon yang lebih berat, membentuk atom muon. Jenis atom ini dapat digunakan untuk menguji prediksi fisika.[126][127][128]
Langganan:
Postingan (Atom)